Een studie naar beroertepreventie bij niet-valvulair atriumfibrilleren (NVAF) patiënten
ENGAGE AF-TIMI 48 is de grootste NOAC studie vs. warfarine met NVAF patiënten tot nu toe met de langste follow-up van 2,8 jaar*
21.105
NVAF patiënten gerandomiseerd
Standaard dosering LIXIANA® 60 mg
Inclusief patiënten met dosisverlaging 30 mg*
(n=7035)
Warfarine (dosis aangepast om streefwaarde INR 2.0-3.0 te behouden)
(n=7036)*
LIXIANA® 30 mg inclusief patiënten op een 15 mg verlaagde dosis*
(n=7034)
30/15 mg behandelingsregime is niet goedgekeurd voor gebruik
Matig tot hoog beroerterisico (CHADS2-score† ≥ 2)
Matig tot hoog beroerterisico (CHADS2-score† ≥ 2)
*vs. warfarine
Studie-opzet2,3
- Een gerandomiseerd, dubbelblind, dubbel-dummy, event-driven fase 3-studie met drie studie-armen. Er werden twee eenmaal daagse LIXIANA®-doseringen vergeleken met warfarine bij patiënten met atriumfibrilleren met een matig tot hoog risico op beroerte
- Een hoog percentage van de deelnemende patiënten had co-morbiditeiten of andere risicofactoren
- Beoordelen of LIXIANA® een veilig en effectief alternatief voor warfarine kan zijn voor beroertepreventie bij patiënten met niet-valvulair atriumfibrilleren
- Effectiviteit: Tijd tot de eerste beroerte (ischemisch of hemorragisch) of systemische embolie
- Veiligheid: Ernstige bloedingen volgens de definitie van de International Society on Thrombosis and Haemostatis (ISTH)
- Leeftijd van 21 jaar of ouder
- Atriumfibrilleren, gedocumenteerd met ECG in de 12 maanden voorafgaand aan de randomisatie
- Matig tot hoog beroerterisico: een CHADS2-score van 2 of hoger†
- Antistollingstherapie gepland voor de gehele looptijd van het onderzoek
- Alle patiënten moesten schriftelijk toestemming geven door middel van een informed consent
- Atriumfibrilleren als gevolg van een omkeerbare aandoening
- Een geschatte CrCl van <30 ml/min
- Hoog risico op bloedingen
- Gebruik van duale antiplaatjes therapie
- Matige tot ernstige mitralisstenose, niet-gereseceerd atriummyxoom of een mechanische hartklepprothese
- Aanwezigheid van andere indicaties voor antistollingsbehandeling
- Een acuut coronair syndroom, coronaire revascularisatie of beroerte in de 30 dagen voorafgaand aan de randomisatie
- Sluiting van het linkerhart oor in de voorgeschiedenis
- Intracardiale massa of linkerventrikel trombus; patiënten bij wie chronische antistolling zal worden stopgezet indien een geplande medicamenteuze, elektrische of chirurgische behandeling erin slaagt een normaal sinusritme te herstellen en vast te houden; contra-indicatie voor gebruik van anticoagulantia
- Chronische behandeling met ciclosporine
- Gelijktijdig gebruik van geneesmiddelen die het risico op bloedingen verhogen
- Actieve leverziekte of aanhoudende verhoging van leverenzymwaarden/bilirubine, alanine-aminotransferase of aspartaataminotransferase ≥2 keer de ULN, totaal bilirubine ≥1,5 keer de ULN
- Patiënten van wie bekend is dat ze positief zijn getest op hiv, hepatitis B-antigeen of antistoffen tegen hepatitis C voorafgaand aan de randomisatie
- Hemoglobine <10 g/dl of een bloedplaatjes count <100.000 cellen/ml
- Aantal witte bloedcellen <3000 cellen/ml
- Andere klinisch relevante afwijkende laboratoriumwaarde
- Al geplande invasieve ingrepen (anders dan een routine-endoscopie) of operaties waarbij bloedingen verwacht worden tijdens de onderzoeksperiode
- Patiënten die in de 30 dagen voorafgaand aan de randomisatie een experimenteel geneesmiddel of hulpmiddel hebben gekregen, of die van plan zijn tijdens de onderzoeksperiode een dergelijk geneesmiddel of hulpmiddel te krijgen
- Patiënten die al eerder gerandomiseerd zijn in een onderzoek met edoxaban
- Vrouwen die kinderen kunnen krijgen, inclusief vrouwen die een tubaligatie hebben ondergaan en vrouwen die <2 jaar postmenopauzaal zijn
- Patiënten met de volgende diagnosen of in de volgende situaties: actieve maligniteit (gediagnosticeerd in de afgelopen 5 jaar) met uitzondering van adequaat behandelde niet-melanome huidkanker of een ander niet-invasief neoplasma of neoplasma in situ dat adequaat behandeld is
- Patiënten die in de afgelopen 5 jaar een behandeling tegen kanker (met geneesmiddelen, bestraling en/of chirurgie) hebben ondergaan
- Patiënten met een significante actieve gelijktijdige medische ziekte of infectie; levensverwachting <12 maanden
- Patiënten met bekende middelen- of alcohol afhankelijkheid in de afgelopen 12 maanden
- Patiënten met een aandoening die, naar mening van de onderzoeker, zou leiden tot een verhoogd risico voor de patiënt als hij/zij aan het onderzoek zou deelnemen; en niet in staat zijn de onderzoeksprocedures volgens plan te ondergaan
ENGAGE AF-TIMI 48: studie met NVAF patiënten die u in de dagelijkse klinische praktijk kunt tegenkomen
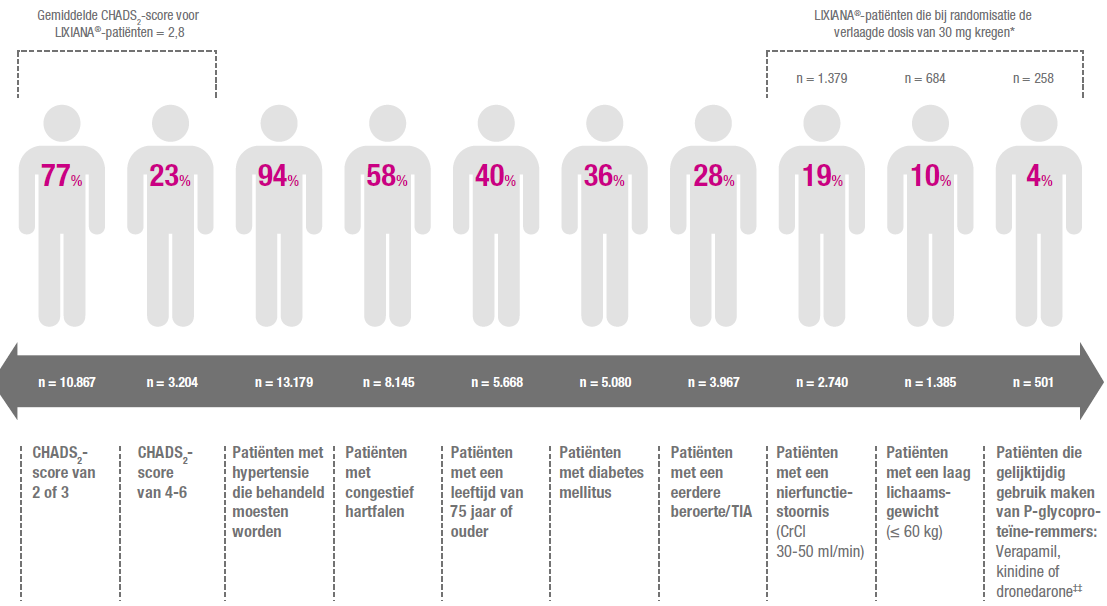
Baseline karakteristieken (% patiënten op LIXIANA® 60 mg/30 mg en warfarine met co-morbiditeiten of andere risicofactoren) bij ENGAGE-AF studie2
Studie highlights
- Bewezen effectiviteit ten opzichte van warfarine
- Superieur veiligheidsprofiel
Primair effectiviteitseindpunt
LIXIANA® heeft bewezen effectiviteit te zijn in het voorkomen van een beroerte en SE bij NVAF patiënten vs. warfarine2
In de gemodificeerde intention-to-treatpopulatie2
De jaarlijkse incidentie van beroerte/SE met eenmaal daags LIXIANA® 60/30 mg vergeleken met warfarine was 1,18% vs. 1,50%;
HR: 0,79; 97,5%-BI: 0,63 tot 0,99; P<0,001 voor non-inferioriteit.
In de intention-to-treatpopulatie2
De jaarlijkse incidentie van beroerte/SE met eenmaal daags LIXIANA® 60/30 mg vergeleken met warfarine was 1,57% vs. 1,80%;
HR: 0,87; 97,5%-BI: 0,73 tot 1,04; P=0,08 voor superioriteit.
Consistente resultaten in subgroepen
LIXIANA® liet een consistente effectiviteit zien voor beroerte/SE vergeleken met warfarine bij NVAF patiënten <65 jaar, 65-74 jaar en ≥75 jaar, evenals voor zeer oude patiënten in de leeftijdscategorieën ≥80 jaar en ≥85 jaar.1
In de vooraf gespecificeerde subgroep analyse liet LIXIANA® een consistente effectiviteit zien voor beroerte/SE vergeleken met warfarine, ongeacht de nierfunctie op baseline.4
LIXIANA® liet een consistente effectiviteit zien voor beroerte/SE vergeleken met warfarine, ook bij NVAF patiënten die een dosisreductie kregen naar edoxaban 30 mg eenmaal daags.2
Primaire veiligheidseindpunt
LIXIANA® liet een superieure reductie van ernstige bloedingen zien vs. warfarine 2§
In het veiligheidscohort2**
De jaarlijkse incidentie van ernstige bloedingen met eenmaal daags LIXIANA® 60/30 mg vergeleken met warfarine was: 2.75% vs. 3,43%§
HR: 0,80; 95%-Bl: 0,71 tot 0,91; P<0.001
Consistente resultaten in subgroepen
LIXIANA® liet een consistente reductie van ernstige bloedingen zien vergeleken met warfarine bij NVAF patiënten <65 jaar, 65-74 jaar en ≥75 jaar, evenals voor zeer oude patiënten in de leeftijdscategorieën ≥80 jaar en ≥85 jaar1
In de vooraf gespecificeerde sub-analyse liet LIXIANA® een consistente reductie van ernstige bloedingen zien vergeleken met warfarine ongeacht nierfunctie4
Lees meer over het consistente effectiviteits- en veiligheidsprofiel van LIXIANA® ongeacht co-morbiditeit.2
Real-world evidence bevestigt LIXIANA® als uw keuze voor oudere NVAF patiënten7
Gegevens van een ‘snapshot’-analyse na 1 jaar van een lopende observationele studie onder 12.574 patiënten met NVAF (ETNA-AF Europa),7 behandeld met LIXIANA® (edoxaban) eenmaal daags, bevestigen de bevindingen van de fase 3-studie (ENGAGE-AF niet-Aziatisch cohort).2,7
* Patiënten kregen een verlaagde LIXIANA®-dosis van 30 mg als er bij hen sprake was van een of meer van de volgende klinische factoren:2
– Nierfunctiestoornis (CrCl 30 tot 50 ml/min)
– Laag lichaamsgewicht (≤60 kg)
– Gelijktijdig gebruik van de volgende P-gp-remmers: verapamil, dronedarone of kinidine2
De SmPC verschilt van de klinische studie. Er is geen dosisverlaging nodig bij gelijktijdig gebruik van verapamil, amiodarone of kinidine. Een eenmaal daagse 30 mg dosis van LIXIANA® is aanbevolen voor patiënten die gelijktijdig gebruik maken van dronedarone, erytromycine, ketoconazol of ciclosporine.6
** Er waren 23 patiënten in de LIXIANA® 60/30 mg-arm en 24 patiënten in de warfarine-arm die geen studiemedicatie kregen. Hierdoor kwam het aantal patiënten per behandelarm bij de veiligheidsanalyse op 7012. Deze veiligheidsanalyse had betrekking op de gemodificeerde intention-to-treat populatie tijdens de behandel periode.2
† CHADS2-score: een gevalideerde maat voor het vaststellen van het beroerterisico. Deze score wordt als volgt berekend: de patiënt krijgt 1 punt per aanwezige risicofactor voor de risicofactoren voorgeschiedenis van congestief hartfalen, hypertensie, leeftijd ≥75 jaar, en diabetes mellitus, en de patiënt krijgt 2 punten bij een voorgeschiedenis van beroerte of TIA.5
§ Het primaire veiligheidseindpunt bij de ENGAGE AF-TIMI 48 studie was de incidentie van ernstige bloedingen1, gedefinieerd door de International Society on Thrombosis and Haemostasis (ISTH) als (i) fatale bloedingen; en/of (ii) symptomatische bloedingen in een kritiek gebied of orgaan, zoals intracraniaal, intraspinaal, intraoculair, retroperitoneaal, intra-articulair, pericardiaal of intramusculair met compartimentsyndroom, en/of (iii) bloedingen die een hemoglobinedaling van 2,0 g/dl of meer veroorzaken of leiden tot transfusie van twee of meer eenheden volbloed of rode bloedcellen.8
HR, hazardratio; SE, systemische embolie; ULN, bovengrens van normaal.
- Kato ET et al. Efficacy and Safety of Edoxaban in Elderly Patients With Atrial Fibrillation in the ENGAGE AF-TIMI 48 Trial. J Am Heart Assoc 2016;5(5). pii: e003432.
- Giugliano RP, Ruff CT, Braunwald E, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013;369:2093-104.
- Ruff CT et al. Evaluation of the novel factor Xa inhibitor edoxaban compared with warfarin in patients with atrial fibrillation: design and rationale for the Effective aNticoaGulation with factor xA next GEneration in Atrial Fibrillation-Thrombolysis In Myocardial Infarction study 48 (ENGAGE AF-TIMI 48). Am Heart J 2010;160:635–641.
- Bohula EA, Giugliano RP, Ruff CT et al. Impact of renal function on outcomes with edoxaban in the ENGAGE AF-TIMI 48 Trial. Circulation 2016;134(1):24–36.
- ACCEL: Assessing Stroke Risk: CHADS2 versus CHA2DS2-VASc, ACC 2013. Te raadplegen op: http://www.acc.org/latest-in-cardiology/articles/2013/11/22/14/43/accel-1-2. Voor het laatst geraadpleegd in: februari2020.
- Samenvatting van de productkenmerken Lixiana november 2020.
- De Groot et al. Edoxaban for stroke prevention in atrial fibrillation in routine clinical care: 1-year follow-up of the prospective observational ETNA-AF-Europe study. Eur Heart J Cardiovasc Pharmacother. 2020 Aug 13;pvaa079.




